2.3 Propriedades da água
A importância da água no sistema terrestre decorre da peculiaridade de sua estrutura molecular. A natureza polar da água e os efeitos das pontes de Hidrogênio explicam a maioria das propriedades exclusivas da água, como: menor densidade na forma sólida, alto calor latente e capacidade térmica, coesão e adesão, alta viscosidade, tensão superficial, capacidade solvente, entre outras propriedades.
2.3.1 Estrutura molecular da água
Na molécula de água 2 átomos de Hidrogênio são unidos a 1 de Oxigênio (H2O) por uma ligação covalente (Figura 2.5). Em particular, a H2O é polar de forma que o ‘lado’ do Hidrogênio tem carga positiva e o do Oxigênio tem carga positiva. Esta polaridade controla o arranjo das moléculas de água entre si na forma líquida e sólida. A extremidade positiva de uma molécula (átomo de Hidrogênio) é atraída pela extremidade negativa (átomo de oxigênio) de outra molécula através das pontes de Hidrogênio.
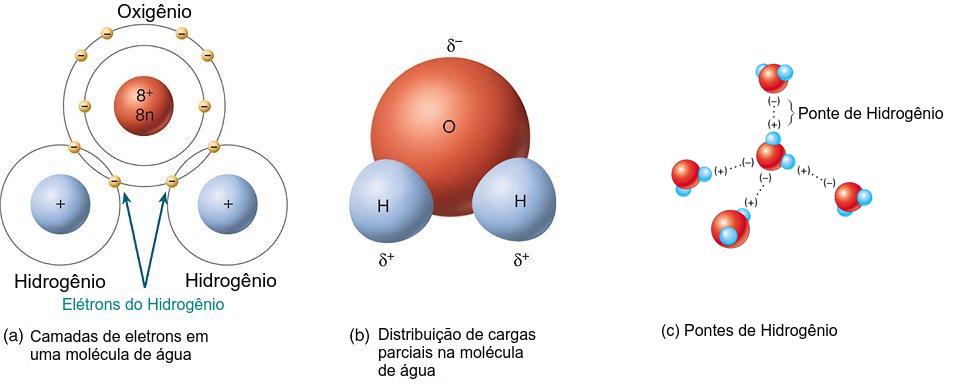
Figura 2.5: Características especiais da estrutura intramolecular (a: ligações covalentes entre os átomos, b: polaridade de uma molécula de água) e intermolecular da água (c: Arranjo entre moléculas de água vizinhas devido as pontes de Hidrogênio). Adaptado de http://bioweb.uwlax.edu/bio203/2010/olson_moll/polarwatermoleculeGOOD.jpg.
2.3.2 Mudanças de fase da água
A Figura 2.6 mostra o diagrama termodinâmico de fases da água pura. De particular relevância é que as condições de pressão e temperatura da Terra no diagrama de fase estão localizadas em uma região em torno dos limites entre as três fases. E de fato, o sistema terrestre é o único em que a água existe nas suas 3 fases, gelo sólido, água líquida e vapor d’água, comparado as condições nos outros planetas.
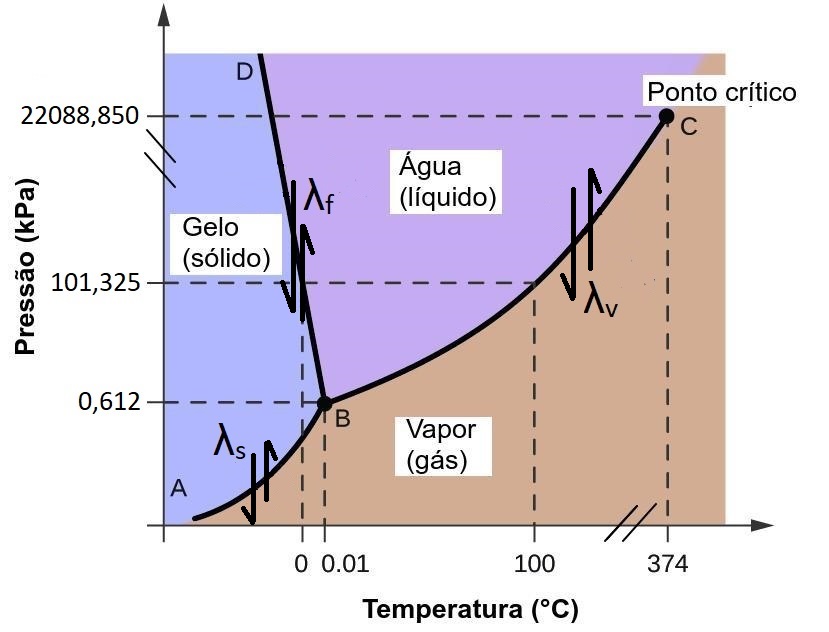
Figura 2.6: Diagrama de fases da água mostrando suas fases em função da temperatura e pressão. As linhas sólidas indicam as curvas de equilíbrio entre as fases. AB: curva de sublimação/deposição, BC: curva de evaporação/condensação, BD: curva de fusão/congelamento. B indica o ponto triplo da água , no qual as 3 fases da água coexistem em equilíbrio. A indica o ponto crítico. \(\lambda_{f}\): calor latente de fusão, \(\lambda_{v}\): calor latente de vaporização, \(\lambda_{s}\): calor latente de sublimação. Adaptado de OpenStax, ‘Diagramas de fase’.
As mudanças de fase da água estão associadas a um absorção/liberação considerável de energia na forma de calor latente. Esta energia não muda a temperatura da água, somente seu estado molecular. Esta é uma das principais razões pelas quais a água e o ciclo hidrológico são de importância primária para o sistema climático.
2.3.3 Densidade da água
A menor densidade do gelo (917 kg m-3) em comparação a água líquida (\(\approx\) 1000 kg m-3) (Figura 2.7) é devido a maneira como as pontes de Hidrogênio são arranjadas quando água congela. No gelo, as moléculas tendem a se separar mais umas das outras do que na água líquida. Isso significa que a água se expande quando congela (maior de volume, menor densidade).
Figura 2.7: Densidade da água e do gelo em função da temperatura.
Esta propriedade especial, explica porque o gelo flutua na superfície dos lagos, ao invés de afundar, o que permite manter a vida aquática em maiores profundidades. Confira a animação na Figura 2.8 para compreender melhor esse comportamento peculiar da água.

Figura 2.8: Animação ‘Porque o gelo flutua na água?’. Fonte: https://ed.ted.com/lessons/why-does-ice-float-in-water-george-zaidan-and-charles-morton#review.
Esta propriedade anômala da água também explica porque a temperatura de fusão (linha BD na Figura 2.6) diminui com o aumento da pressão.
2.3.4 Capacidade térmica
A capacidade térmica é a quantidade de energia necessária para alterar uma dada massa da substância em 1 °C. Para a água, a capacidade de calor específico (cp) em T = 0 °C é 4216 J kg-1 K-1, praticamente o dobro da solo. Como muitas propriedades da água, isso pode variar com a temperatura, conforme mostrado na Tabela abaixo.
| Temperatura (°C) | Densidade (Kg m-3) | Capacidade térmica (J Kg-1 K-1) |
|---|---|---|
| 0 | 999.87 | 4216 |
| 15 | 999.13 | 4184 |
| 30 | 9995.67 | 4177 |
Esta é a maior capacidade de calor específico de qualquer substância conhecida. Então, por que essa propriedade é tão importante ao clima na Terra? O principal efeito é amortecer as mudanças de temperatura. Grande parte da energia solar que entra no topo da atmosfera da Terra atinge a superfície, uma fração significativa da qual é coberta por água. A alta capacidade de calor da água significa que grande parte dessa energia pode ser absorvida com mudanças de temperatura relativamente pequenas. Um planeta sem água aqueceria muito mais significativamente com a mesma entrada de energia. Este efeito também pode ser visto em padrões climáticos regionais. As áreas costeiras perto de grandes corpos d’água geralmente têm um clima mais ameno (isto é, baixa amplitude térmica diária) em comparação com as do interior, devido à capacidade de moderação do corpo d’água. Em outro exemplo, o corpo humano aproveita a alta capacidade de calor da água para regular a temperatura do corpo dentro da pequena faixa necessária para o funcionamento saudável.
2.3.5 Calor latente
No diagrama de fases vimos que energia é necessária para derreter gelo e evaporar água. Esta energia não muda com a temperatura da água, mas sim seu o estado molecular. Por isto essa energia é chamada calor latente. Ela fica armazenada nas moléculas de água e é liberada no processo reverso, como por exemplo, quando o vapor d’água condensa para forma líquida.
O calor latente de vaporização (Lv) é a energia consumida na transformação de água líquida em vapor d’água (ou liberada na conversão de vapor em líquido) e tem um valor (em T = 0 ° C) de Lv = 2,5 × 106 J kg-1 . Esta propriedade tem leve variação com a temperatura (por exemplo, é igual a 2,25 x 106 J kg-1 a 100° C), mas para a maioria das aplicações, podemos usar este valor nominal.
O calor latente de fusão (Lf) é a energia consumida na transformação de água sólida (gelo) em água líquida (ou liberada na conversão de líquido em gelo) e tem um valor nominal de Lf = 3,34 × 105 J kg-1. Observe que isso é quase uma ordem de magnitude menor que o calor latente de vaporização.
O calor latente de sublimação (Ls) é a energia consumida na transformação do gelo em vapor d’água (ou liberada na conversão do vapor em sólido) e possui um valor nominal de Ls = 2,85 × 106 J kg-1.
As grandes quantidades de energia necessárias para quebrar as ligações de hidrogênio entre as moléculas de água tornam essas propriedades muito maiores em comparação com outras substâncias. O fato de esses calores latentes serem tão grandes para a água, aliado ao fato de as transformações de fase serem bastante comuns no sistema terrestre, resultam em fontes e sumidores de energia significativas para ciclo hidrológico. Especificamente, o calor latente é crítico na transferência de energia entre a superfície e a atmosfera e no transporte global de calor.